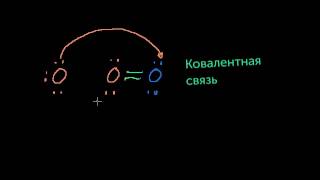
Ионная связь. Химия. 8 класс
Тренировочный тест к уроку по ссылке: https://chem-oge.sdamgia.ru/test?id=1...
Шпаргалки по химии на сайте: https://www.himikus.com/
Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами. • Каждый элемент в большей или меньшей степени обладает способностью притягивать электроны, которая численно характеризуется значением электроотрицательности. Соответственно, чем больше электроотрицательность элемента, тем сильнее он притягивает электроны и тем сильнее выражены его окислительные свойства. • Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень. • Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни. • Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами. Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной. • Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов.